Generalidades
Materia
Es todo lo que tiene masa e inercia y ocupa un lugar en el espacio.
Energía
Capacidad para realizar un trabajo o transferir calor.
Trabajo
Desplazamiento de una masa a lo largo de una distancia.
Masa
Es una medida de la cantidad de materia ( la masa no cambia ).
Peso
Es la acción de la fuerza de gravedad sobre la masa de un objeto en particular.
Propiedad
Es una característica o cualidad que permite describir a un cuerpo.
Propiedad General
Característica o cualidad común a todos los cuerpos y no permiten diferenciarlos individualmente.
Propiedad Específica
Característica o cualidad que permite identificar a un cuerpo.
Propiedad Física
Característica o cualidad de una sustancia que identifican sin alterar su composición: Color, olor, densidad, punto de fusión, punto de ebullición, dureza, lustre metálico, ductilidad.
Propiedad Química
Característica que relaciona los cambios de composición de una sustancia o sus reacciones.
Materia y Energía
Materia
Es todo lo que forma el mundo físico, ocupa un lugar en el espacio, tiene masa y es susceptible de medición.
División de la Materia
Cuerpo
Porción de materia de extensión limitada y produce impresiones en nuestro sentido por cualidades propias. Porción de materia visible, por ejemplo, un marcador.
Partícula
Parte de la materia que apenas se observa, por ejemplo: cristales de cloruro de sodio.
Molécula
Mínima porción de materia que existe libre y conserva su propiedad, no es visible, pero se lo puede apreciar en las disoluciones, por ejemplo: solución de cloruro de sodio y agua.
Átomo
Partícula más pequeña que conserva las propiedades de un elemento químico: el agua tiene un átomo de oxígeno y dos átomos de hidrógeno.
Partícula elemental o micro partícula
Porción de materia menor que el átomo de hidrógeno, por ejemplo: electrones, neutrones, protones.
Electrón
Partícula, elemental de carga negativa(1,602192 * 10-19 C ) y masa en reposo de 9,109558 * 10-31 kg. Los electrones están presentes en todos los átomos en niveles energéticos alrededor del núcleo.
Protón
Partícula elemental con carga positiva (+1,6021 * 10-19 C ) y masa en reposo 1,672614 * 10-27 kg. Los protones son nucleones que se encuentran en todos los núclidos.
Neutrón
Partícula elemental de carga eléctrica nula, con una masa igual a 1,6748210 * 10-27 kg , ligerísimamente superior a la del protón.
Clasificación de las Sustancias por su Composición Química
Sustancias Simples
Metales
Cuerpo simple, sólido a la temperatura ordinaria, a excepción del mercurio(líquido) se distingue de los demás sólidos, por su brillo especial cuando se pulen, electropositivos monoatómicos.

No metales
son elementos electronegativos con tendencia a formar compuestos covalentes o iones negativos. En estado sólido son cristales covalentes volátiles o cristales macromoleculares. Entre los no metales muy conocidos como el nitrógeno y el oxígeno están presentes en la atmósfera; el carbono en forma de grafito, carbón vegetal, entre otros.

Gases Nobles
Grupo de gases monoatómicos y de baja ebullición, conocidos como pertenecientes al grupo (0).
Los gases nobles: Helio, Neón, Argón, Criptón, Xenón y Radón, están en la columna derecha de la tabla periódica.
Los gases nobles se denominan así porque no se combinan con otros elementos para formar compuestos.
Características de las Sustancias Simples
METALES | NO METALES | GASES NOBLES |
Sólidos excepto el mercurio. Tienen brillo metálico. Son buenos conductores del calor y la electricidad. Los forman iones positivos o negativos metálicos. Son dúctiles y maleables. Electropositivos: pierden electrones e-. Con el oxígeno forman óxidos básicos. | Sólidos o gases excepto el bromo. Son opacos. Malos conductores del calor y la electricidad. Los gases están formados por moléculas diatómicas y lo sólidos por iones. No son dúctiles ni maleables. Electronegativos: ganan electrones e-. Con el oxígeno forman óxidos ácidos. | Todos son gases. Son incoloros. Se ionizan y brillan ante descargas eléctricas, buenos conductores de calor. Se integran por moléculas monoatómicas. Estables no ganan ni pierden electrones. No reaccionan con otros elementos. |
Sustancias Compuestas
Mezclas
Unión física de dos o más sustancias o cuerpos que no tiene entre sí acción química y cada una conserva sus propiedades. Se dividen en:
Homogéneas
Presentan un color uniforme impidiendo distinguir las partículas de sus componentes.
Ejemplos:
Agua con sal

Aire

Mayonesa

Aleación: Acero

Heterogéneas
Presentan un color uniforme impidiendo distinguir las partículas de sus componentes.
Ejemplos:
Ensalada

Agua con Aceite

Granito, Arena y Agua

Separación de Mezclas
Trituración
Operación de Fraccionamiento de un cuerpo sólido.
Disolución
Separación de moléculas de una sustancia por acción de un líquido disolvente.

Precipitación
Operación por la cual una sustancia soluble se transforma en otra insoluble por acción de un reactivo u otros procedimientos.

Procedimiento de separación de mezclas fluidas por medio de la capilaridad, se aislan sustancias disueltas en un mismo solvente.

Cristalización
Separación en forma de cristales de un sólido disuelto mediante la separación de su disolvente.

Tamización
Operación de cernido de dos o más sólidos de diferente tamaño de partícula.

Centrifugación
Operación que consiste en dar vueltas o revoluciones a las sustancias líquidas mezcladas. Los componentes se separan de acuerdo a su densidad.

Evaporación
Operación que emplea el calor para separar un sólido de un líquido.

Operación que consiste en aplicar calor para evaporar los líquidos y luego condensarlos. Así se separan los líquidos que tienen diferentes puntos de ebullición.

Decantación
Operación que consiste en separar los componentes luego de que se los ha sedimentado.

Filtración
Separación de las partículas sólidas en suspensión en un fluido, mediante el paso forzado de éste a través de un medio filtrante o membrana sobre la que se depositan los sólidos.

Combinación
Unión íntima de dos o más elementos que intervienen en proporciones constantes de peso y volumen, y que sometidos a procedimientos químicos o energéticos de alto poder dan como resultado un nuevo cuerpo, totalmente diferente a sus partículas elementales o imposibles de descomponer por mecanismos sencillos.
Diferencias entre Mezcla y combinación
MEZCLA | COMBINACIÓN |
Los componentes intervienen en cualquier proporción. Los componentes conservan sus propiedades específicas. Los componentes pueden separarse por medios físicos o mecánicos. No tiene composición constante o fórmula química. | Componentes en proporciones fijas. Los componentes pierden sus propiedades específicas. Los componentes pueden separarse por medios químicos o físicos altamente energéticos. Tienen composición constante expresada en fórmula química. |
Propiedades de la Materia
Propiedades Generales
Volumen
Se refiere al lugar que ocupa todo cuerpo en el espacio.
Si el sólido es irregular nos ayudamos de un líquido (normalmente agua) y utilizamos el «método de inmersión». El volumen del sólido será la diferencia entre el volumen señalado por la probeta en (2) menos el volumen señalado en (1). El error coincide, en este caso, con la precisión de la probeta.

Si el sólido es regular (cubo, ortoedro, cilindro, etc.), el volumen se obtiene midiendo las dimensiones importantes y aplicando luego fórmulas matemáticas conocidas. En este caso, el error vendrá dado por la precisión de la regla utilizada para medir las dimensiones

Divisibilidad
Propiedad que tiene todo cuerpo para subdividirse en partículas más pequeñas.

Impermeabilidad
Es la capacidad de un cuerpo para impedir el ingreso de otro.

Inercia
Estado de reposo o movimiento de un cuerpo y solo se modifica por intervención de una fuerza externa.

Masa
Es la cantidad de materia que contiene un cuerpo (g y kg).

Peso
Es la fuerza con que el planeta atrae a los cuerpos ( g. Fuerza).
Propiedades Específicas
Las propiedades especificas de la materia, son aquellas propiedades que caracterizan a una sustancia y que la hace diferente de las demás.
Propiedades Físicas
Las propiedades físicas de la materia son el conjunto de características que permiten su estudio usando los sentidos o algún instrumento específico.
Forma Cristalina
Se refiere a que muchas sustancias sólidas, tienen diferentes formas geométricas cristalinas. Ejemplos: azúcar, cuarzo.
Densidad
Es la relación entre la masa y el volumen de un cuerpo.
Dureza
Es la oposición que presentan los materiales a ser rayados.
El vidrio y el diamante son materiales duros, pues es difícil rayarlos.
El yeso, por el contrario, es un material más blando; se raya con facilidad.

Color
El color es una percepción visual que se genera en el cerebro al interpretar las señales nerviosas que le envían los fotorreceptores de la retina del ojo y que a su vez interpretan y distinguen las distintas longitudes de onda que captan de la parte visible del espectro electromagnético.
Es un fenómenofísico-químico asociado a las innumerables combinaciones de la luz, relacionado con las diferentes longitudes de onda en la zona visible del espectro electromagnético, que perciben las personas y animales a través de los órganos de la visión, como una sensación que nos permite diferenciar los objetos con mayor precisión.

El olor es una propiedad intrínseca de la materia y se define como la sensación resultante de la recepción de un estimulo por el sistema sensorial olfativo. El término “olor” se refiere a una mezcla compleja de gases, vapores, y polvo, donde la composición de la mezcla influye directamente en el olor percibido por un mismo receptor. Aquello que carece de olor se denomina inodoro. El olor es el objeto de percepción del sentido del olfato.
Sabor
El sabor es la impresión que nos causa un alimento u otra sustancia, y está determinado principalmente por sensaciones químicas detectadas por el gusto (paladar) así como por el olfato (olor).
La maleabilidad es la propiedad que presentan algunos materiales de poder ser descompuestos en: láminas sin que el material en cuestión se rompa, o en su defecto, extendidos.
Por ejemplo, los metales conocidos comometales maleables son aquellos que justamente cumplen con esta propiedad que mencionamos, el estaño, el cobre, el aluminio.

Ductibilidad
Es la propiedad por la cual ciertos cuerpos pueden reducirse a hilos muy delgados.

Punto de Fusión
El punto de fusión es la temperatura a la cual la materia pasa de estado sólido a estado líquido, es decir, se funde.
Punto de Ebullición
El punto de ebullición es aquella temperatura en la cual la materia cambia de estado líquido a gaseoso, es decir se ebulle. Expresado de otra manera, en un líquido, el punto de ebullición es la temperatura a la cual la presión de vapor del líquido es igual a la presión del medio que rodea al líquido.1 En esas condiciones se puede formar vapor en cualquier punto del líquido.
Solubilidad
Es la propiedad de las sustancias para difundirse o disolverse con otro, se debe a la interacción molecular. Ejemplo: Agua con alcohol.
Conductividad eléctrica
Capacidad de un cuerpo para conducir electricidad. Ejemplo: Los mejores conductores son los metales: cobre, plata, oro y aluminio.
Conductividad térmica
Capacidad de un cuerpo para conducir calor. Ejemplo: los metales son buenos conductores del calor.
Propiedades Químicas
Son aquellas propiedades distintivas de las sustancias que se observan cuando reaccionan, es decir, cuando se rompen o se forman enlaces químicos entre los átomos, formándose con la misma materia sustancias nuevas distintas de las originales. Las propiedades químicas se manifiestan en los procesos químicos (reacciones químicas).

Energía
Es la capacidad de un cuerpo para realizar un trabajo o transferir calor, dependiendo de donde proviene:
Energía Mecánica
La energía mecánica es la energía que se debe a la posición y al movimiento de un cuerpo, por lo tanto, es la suma de las energías potencial, cinética y la elástica de un cuerpo en movimiento. Expresa la capacidad que poseen los cuerpos con masa de efectuar un trabajo.
Energía Térmica
Es la energía que se transfiere de un cuerpo a otro debido a su diferencia de temperaturas. También recibe el nombre de calor. La unidad de energía térmica es el julio, pero aún se sigue utilizando la unidad histórica del calor, la caloría.
Energía Eólica
Es la energía producida por el viento, generada por efecto de las corrientes de aire.
Energía Eléctrica
Es la forma de energía resultante de la existencia de una diferencia de potencial entre dos puntos, lo que permite establecer una corriente eléctrica entre ambos —cuando se les coloca en contacto por medio de un conductor eléctrico—para obtenertrabajo. La energía eléctrica puede transformarse en muchas otras formas de energía, tales como la energía luminosa o luz, la energía mecánica y la energía térmica.
Su uso es una de las bases de la tecnología utilizada por el ser humano en la actualidad.
Energía Nuclear
Es la energía que se libera espontánea o artificialmente en las reacciones nucleares.
Energía Solar
Es la energía radiante producida en el sol.
Es la energía obtenida mediante la captación de la luz y el calor emitidos por el Sol.La radiación solar que alcanza la Tierra puede aprovecharse por medio del calor que produce a través de la absorción de la radiación, por ejemplo en dispositivos ópticos o de otro tipo.
Energía de Activación
Es la energía necesaria para que se produzcan las colisiones entre las moléculas. La energía de activación depende de las moléculas participantes.
Energía Potencial
Es energía que mide la capacidad que tiene dicho sistema para realizar un trabajo en función exclusivamente de su posición o configuración. Puede pensarse como la energía almacenada en el sistema, o como una medida del trabajo que un sistema puede entregar. Suele abreviarse con la letra U o Ep .
Ep=m*g*a
Ep=energía potencial
m=masa
g=gravedad
a=altura
Energía Cinética
Energía que un objeto posee debido a su movimiento. La energía cinética depende de la masa y la velocidad del objeto según la ecuación.
Ec= (1/2)mv2
Ec= energía cinética
m=masa del objeto
v=velocidad del objeto
Ley de la Conservación de la Masa
"La materia no se crea ni se destruye, solo se transforma"
Ley de la Conservación de la Energía
"La cantidad total de energía del universo permanece constante; no se crea ni se destruye, solo se transforma"
Ley de la conservación de la Materia-Energía
"La cantidad total de materia y energía que contiene el universo es constante y solo hay transformaciones entre ellas"
Albert Einstein (1879-1955) formuló la siguiente ecuación E=mc²
E=energía de la partícula
m=masa de la partícula
c=velocidad de a luz
Cambios físicos y químicos
Cambio físico
Es áquel que ocurre externamente. No existe un cambio interno en la estructura de la materia, ya que no existe una reordenación de átomos; no se forman sustancias nuevas. Es un cambio de estado, por tanto es reversible.
Cambio químico
Cambio que ocurre internamente. En él existe una reordenación de átomos dando origen a sustancias nuevas. Este cambio es el resultado de una reacción química: generalmente es irreversible.
El átomo
Etimológicamente átomo, significa sin división.
conjunto de corpúsculos subatómicos asociados en números determinados que tienen masa y carga eléctrica determinada.
el modelo atómico actual se basa en la mecánica cuántica, según los investigadores el átomo no tiene forma definida, sino más bien parece una nube cósmica que varía constantemente.
Modelos Atómicos
MODELO | AÑO | CARACTERÍSTICAS | ESQUEMA | |
Dalton | 1803 | *No es posible tener partes fraccionarias de átomos. *Todos los átomos de un elemento son idénticos | ||
Thompson | 1904 | *La materia es neutra *La forma es como una esfera en su interior existen partículas positivas. *En la superficie existen incrustadas partículas negativas. *Existe igualdad de partículas positivas y negativas. | ||
Rutherford | 1911 | *Existe un núcleo con carga Positiva. *Los electrones giran alrededor del núcleo. | ||
Bohr | 1913 | *La teoría de la estructura atómica se basa en la mecánica cuántica. *Los electrones ocupan varios niveles de energía, alrededor del núcleo, cada nivel posee uno o más subniveles y cada subnivel uno o más suborbitales. | ||
Sommerfeld | Órbitas elípticas alrededor del núcleo. |
Estructura del Átomo
Estructura del átomo
Núcleo Atómico
La parte interna del átomo, formado por partículas denominadas nucleones, de dos clases: protones y neutrones.
Un nucleón es considerado como la unidad de masa atómica (uma).
Envoltura
Es la parte externa del átomo, donde circulan los electrones.
Los electrones giran alrededor del núcleo, acercándose o alejándose del núcleo, circulan en un espacio llamado orbital.
De acuerdo a la mecánica cuántica la envoltura del núcleo no tiene forma es similar a las nubes del firmamento, constantemente cambian de forma.
Representación simbólica del Átomo (Núcleo)
El símbolo general para el núcleo de cualquier elemento es el siguiente:
A
ZX
A= Número de Masa
Z=Número Atómico
X=Símbolo del elemento
Número Másico o número de Masa
Representa la suma de la masa de los protones y neutrones del núcleo, ya que la masa de los electrones es despreciable. Se representa con la letra mayúscula A.
Número atómico
Es el número de protones o carga que se representa por la letra zeta mayúscula (Z).
Número Cuántico Magnético (m)
El número cuántico magnético nos indica las orientaciones de los orbitales magnéticos en el espacio, los orbitales magnéticos son las regiones de la nube electrónica donde se encuentran los electrones, el número magnético depende de l y toma valores desde -l hasta l.
Número atómico
Es el número de protones o carga que se representa por la letra zeta mayúscula (Z).
Z= A + N
Isótopos, Isóbaros, Isótonos
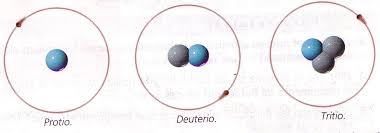
Isótopos
Son átomos que tienen igual número atómico y diferente número másico.
A= 1(1p++0N°)
Isótopos del hidrógeno
Isóbaros
Son átomos de igual masa atómica, pero de diferente número atómico.
Isótonos
Son átomos que tienen igual número de neutrones.
Distribución electrónica
- Principio de Incertidumbre de Heisemberg
Heisemberg basado en hechos experimentales formulo su principio de incertidumbre o inderteminación.
Este principio afirma que no se puede conocer simultáneamente la cantidad de movimiento y la posición de un electrón con la precisión necesaria para trazar su trayectoria en un determinado nivel de energía.
La región de mayor probabilidad para encontrar un electrón se denomina orbital.
Números Cuánticos
Los números cuánticos son 4:
Número Cuántico Principal (n)
El número cuántico principal n Este número cuántico indica la distancia entre el núcleo y el electrón, medida en niveles energéticos, pero la distancia media en unidades de longitud también crece monótonamente con n. Los valores de este número, que corresponde al número del nivel energético, varian entre 1 e infinito, mas solo se conocen átomos que tengan hasta 7 niveles energéticos en su estado fundamental.
Número Máximo de electrones por cada Nivel
CAPA | NIVEL | # Máximo de electrones |
K L M N O P Q | 1 2 3 4 5 6 7 | 2*12=2 2*22=8 2*32=18 2*42=32 2*52=50 2*62=72 2*72=98 |
Número Cuántico Secundario (l)
Este número cuántico nos indica en que subnivel se encuentra el electrón, este número cuántico toma valores desde 0 hasta (n - 1), según el modelo atómico de Bohr - Sommerfield existen además de los niveles u orbitas circulares, ciertas órbitas elípticas denominados subniveles.
Este número cuántico nos indica en que subnivel se encuentra el electrón, este número cuántico toma valores desde 0 hasta (n - 1), según el modelo atómico de Bohr - Sommerfield existen además de los niveles u orbitas circulares, ciertas órbitas elípticas denominados subniveles.
SUBNIVEL | ORBITAL | # Máximo de electrones |
s | 1 | 1*2=2 |
p | 3 | 3*2=6 |
d | 5 | 5*2=10 |
f | 7 | 7*2=14 |
Número Cuántico Magnético (m)
El número cuántico magnético nos indica las orientaciones de los orbitales magnéticos en el espacio, los orbitales magnéticos son las regiones de la nube electrónica donde se encuentran los electrones, el número magnético depende de l y toma valores desde -l hasta l.
Número Cuántico de Spin (s)
El número cuántico de spin nos indica el sentido de rotación en el propio eje de los electrones en un orbital, este número toma los valores de -1/2 y de 1/2.
De esta manera entonces se puede determinar el lugar donde se encuentra un electrón determinado, y los niveles de energía del mismo, esto es importante en el estudio de las radiaciones, la energía de ionización, así como de la energía liberada por un átomo en una reacción.
El número cuántico de spin nos indica el sentido de rotación en el propio eje de los electrones en un orbital, este número toma los valores de -1/2 y de 1/2.
De esta manera entonces se puede determinar el lugar donde se encuentra un electrón determinado, y los niveles de energía del mismo, esto es importante en el estudio de las radiaciones, la energía de ionización, así como de la energía liberada por un átomo en una reacción.
Resumen de Números Cuánticos
NÚMERO CUÁNTICO | SÍMBOLO | CARACTERÍSTICA | VALOR |
Principal | n | Es un entero que representa el nivle de energía del electrón. | 1, 2, 3, 4, 5, 6, 7 |
Seundario | l | Llamado también orbital, de acuerdo a la mecánica puede tomar valores desde 0 hasta n-1 y l viene indicando por las letras minúsculas s, p, d, f. | 0,1, 2, 3…….., n-1 |
Terciario o Magnético | m | Describe las orientaciones especiales de los orbitalees tomando valores (+1) pasando por 0 hasta llegar al (-1) | -1, 0, 1 |
Spin | s | Se refiere a las características al considerar un movimiento de giro del electrón sobre su propio eje, el spin puede tener solo dos valores (+1/2) y (-1/2) | ½ 0 -1/2 |
Configuración Electrónica de Átomos
Se debe tener en cuenta ciertos principios o reglas que permiten asignar configuraciones electrónicas probables para los átomos de los diversos elementos. Es recomendable seguir el esquema de Aufbau.
Principio de Exclusión de Pauli
En un átomo cualquiera, no pueden existir dos electrones cuyos números cuánticos tengan los mismos valores, es decir, en un orbital solo pueden encontrarse dos electrones con spines contrarios.
Principio de la Multiplicidad Máximo de Hund
En los orbitales correspondientes a un subnivel, primero se llena el orbital con un solo electrón y los electrones que sobran se empiezan a ubicarles desde el inicio en el respectivo espacio(sirve para determinar el número de electrones no apareados).
Configuraciones Electrónicas y Diagramas de Orbitales

Formas que adopten los Orbitales en el Espacio

Cada tipo de orbital tiene una forma única, es decir, que la región en el espacio que representa la nube electrónica para ese par determinado de electrones tiene una forma determinada.
Estas formas son las siguientes:
Forma esférica para el orbital s.
Forma de peras unidas por la parte más angosta para el orbital p, (con las peras localizadas bien sea en el eje x, en el eje y o en el eje z).
Nube electrónica de 4 lóbulos para orbitales d.
muchas graciasmuchas garc!!!!
ResponderEliminargracias fue muy util y preciso
ResponderEliminarMe gusta
ResponderEliminar